
为您节约时间,可输入您的号码点击回电,直接电话咨询!
作者:李鼎锋/郭钧/刘蜀彬/崔秋/刘铖 来源:《中国骨与关节杂志》2015年5月第4卷第5期

【摘要】目的 探讨经动脉新辅助化疗治疗软组织恶性纤维组织细胞( malignant fibrous histiocytoma,MFH)的疗效,并分析软组织MFH预后相关因素。方法 回顾性分析1999年9月至2011年12月,我院收治的101例软组织MFH患者的临床资料。所有病例均经化疗泵动脉给予顺铂、阿霉素、去甲斑蝥素化疗。根据患者就诊时是否进行过治疗的情况分原发肿瘤组和复发肿瘤组两组,分别为44例(A组)和57例(B组),每组再根据治疗方式为新辅助化疗结合手术或单纯新辅助化疗各细分为2组。A组中手术切除的15例,为A1组;未行手术治疗的29例,为A2组。B组中行肿瘤手术的45例,为B1组;未行手术的12例,为B2组。采用肿瘤坏死率来判断手术患者化疗的疗效。观察5年总体生存率、5年无瘤生存率、复发及转移情况,并对患者年龄、性别、肿瘤大小、肿瘤部位、肿瘤浸润组织深度、肿瘤是否复发、病理类型、组织学分级及化疗后组织反应等9项影响预后的因素进行统计学分析。结果 本组101例随访3-145个月,平均60个月。(1)本研究共23例肿瘤切除标本进行了肿瘤坏死率分析,A1组5例肿瘤切除标本中肿瘤坏死率75.0%,4例(80.0%)化疗反应好,B1组18例肿瘤坏死73.8%,14例(77.8%),14例(77.8%)化疗反应好,两组肿瘤坏死率及化疗反应好者比率相比,差异无统计学意义(P>0.05)。(2)本组总体生存率65.3%,原发组5年无瘤生存率和总体生存率分别为70.5%和75.0%,复发组5年无瘤生存率和总体生存率分别为56.1%和57.9%,两组的总体生存率相比,差异有统计学意义(P<0.05)。(3)单独局部复发者共18例(17.8%),其中A组7例(15.9%),B组11例(19.3%),平均复发时间14个月;单独远处转移共5例(50%),A组1(2.3%),B组4例(7.0%),平均转移发生时间1年(2~50个月);局部复发伴远处转移者共15例(14.9%)(4)患者年龄(P=0.03)、肿瘤大小(P=0.01)、骨盆部位(P=0.02),肿瘤是否复发(P=0.004)、组织学分级(P=0.01)、化疗后组织反应(P=0.007)与5年总体生存率相关。多因素分析显示,肿瘤大小(P=0.002)、骨盆部位肿(P=0.01)、肿瘤是否复发(P=0.0004)、组织学分级(P=0.002)、化疗后组织反应(P=0.008)是影响预后的最主要因素。(5)本组病例化疗后一般情况均可,主要并发症为中性粒细胞减少症(79%)。结论采用顺铂、阿霉素及去甲斑素经动脉新辅助化疗能明显增加化疗疗效、提高生存率。该方法是治疗MFH的有效方法。肿瘤部位、大小、组织学分级、是否复发、对化疗反应等因素明显影响预后。
【关键词】软组织肿瘤 放化疗 组织细胞瘤 恶性纤维 预后
A study of clinical effects and prognosis factors on transarterial neoadjuvant chemotherapy of malignant fibrous histiocytoma in soft tissues GUO Jun, LI Ding-feng, LIU Shu-bin, CUI Qiu, LIU Cheng. Department of Orthopedics,the Affiliated Hospital of Academy of Military Medical Sciences, PLA 307th Hospital, Beijing, 100071, PRC Correspondingauthor:LiDing-feng,Email:307yygk@sina.com.
【Abstract 】Objective To explore clinical effects in transarterial neoadjuvant chemotherapy of malignant fibrous histiocytoma( MFH ) in soft tissues, and to analyze the factors related to the prognosis of MFH in soft tissues. Methods From September 1999 to December 2011, clinical documents of 101 MFH in soft tissues patients treated by transarterial administration of Cisplatin( CDDP), Adriamycin( AMD )and Norcantharidin( NTCD )were reviewed. All the patients were divided into primary group( group A, 44 cases )and recurrent group (group B, 57 cases)and each group was further divided into 2 groups by treatment methods. Fifteen patients( group A1)in group A received surgical resection, and the other 29 patients( group A2 )received simple transarterial neoadjuvant chemotherapy. Forty-five patients( group B1 )in group B received surgical resection and the other 12 patients( group B2 )received simple transarterial neoadjuvant chemotherapy. For patients in the operation groups, chemotherapy effects were determined from the tumor necrosis rate in the resected specimen. The 5-year relapse-free survival rate, the overall survival rate,recurrence and metastasis were observed. Nine factors that might affect prognosis such as age, sex, tumor size, tumor site,tumor infiltration depth, recurrence occurrence, pathological type, histological grade and histological response of chemotherapy were analyzed statistically. Results One hundred and one cases received follow-up. The average follow -up period was 60 months( range: 3-145 months ).(1)Twenty-three resected specimens were analyzed by tumor necrosis rate. 4/5 cases(80.0%)in group A1 showed good chemotherapy response and the average tumor necrosis rate was 75.0%; 14/18 cases(77. 8%)in group BI1showed good chemotherapy response and the average tumo necrosis rate was 73.8%; The differences between the two groups were not significant. P>0.05 ).( 2 )The 5-year relapse-free survival rate and the overall survival rate were 70. 5% and 75.0% respectively in primary group, 56.1% 57.9% respectively in recurrent group. The differences of overall survival rate between the two groups were significant P<0.05 ).(3 ) Eighteen patients showed simple local recurrence( 17.8%): 7 in group A(15.9%)and ll in group B(19.3%). The average recurrence time was 14 months. Five patients(5.0%)showed simple distant metastasis I in group A(2.3%)and 4 in group B(7.0%). The average metastasis time was I year( range: 2-50 months). Fifteen patients showed local recurrence accompanied by distant metastasis( 14.9%)( 4) The age( P=0.03 ), tumor size (P-0.01), pelvic condition( P=0.02 ), recurrence occurrence( P 0.004), histological grade(P-0.01 ) histological response of chemotherapy( P=0.007)were related to 5-year overall survival rate. Multivariate analysis showed that major factors affecting prognosis were: pelvic condition( P-0. 01 ) tumor size( P-0.002 ) histological grade (P=0.002 ) recurrence occurrence( P=0.0004), histological response of chemotherapy( P-0.008).(5)The general condition was good and the major complication of chemotherapy was neutropenia( 79%).Conclusions Transarterial neoadjuvant chemotherapy of CDDP, AMD and NTCD ) can significantly increase the ve efhi of chemotherapy and survival rate in MFH treatment. Tumor site, tumor size, histological grade, recurrence occurrence,histological response of chemotherapy can affect the prognosis significantly .
【 Key words】Soft tissue neoplasms; Chemoradiotherapy;Histiocytoma, malignant fibrous; Prognosis.
恶性纤维组织细胞瘤( malignant fibrous histioc-stoma,MFH)是1964年由 OBrien和 Stout首先报道的[1]。但是该肿瘤的异质性显著,病理学上与其它肿瘤有很多重叠,是否能成为独立的疾病类型受到很大质疑。尽管目前对MFH的病理类型、细胞起源等有了更深入的认识,然而对MFH的治疗及预后因素的判断等一直存在很大争议。
1999年9月至2011年12月,我院尝试采用经动脉新辅助动脉化疗时联合应用促进肿瘤细胞凋亡剂一去甲斑蝥素治疗软组织MFH得到了较满意的临床疗效,现报告如下。
资料与方法
一、纳人和排除标准
纳人标准:(1)经病理检查证实为MFH;(2)初次来我院就诊时未发生远处转移;(3)无其它肿瘤病史;(4)心功能正常;(5)具有完整临床及病理资料并获得随访。
排除标准:(1)初次就诊已发现远处转移;(2)经过至少2次手术及其它不规范治疗者;(3)合并其它疾病如心脑血管疾病。
二、治疗方法
1.分组:根据以上标准,共有101例纳入本研究,其中男65例,女36例。年龄16~89岁,平均年龄58.5岁。本组中肿瘤发生于下肢61例、上肢20例、骨盆9例、躯干6例、其它部位5例。肿瘤大小<5cm者18例肿瘤,≥5cm者83例,最大直径29cm。86例肿瘤位于筋膜下,15例位于皮下,86例肿瘤部位深在(深筋膜下)且肿瘤直径>5cm。肿瘤发病部位与大小深度等分布情况与多数文献报道一致[2-8]。肿瘤组织学分级情况:高分化肿瘤G1有3例,中分化肿瘤G2有12例,低分化肿瘤G3有86例。肿瘤病理分型及组织学分级参照新版WHO软组织肿瘤分类标准[9]及 Enzinger等分级标准[10]。
回顾性分析入选患者治疗资料,根据患者就诊时是否进行过治疗的情况分原发肿瘤(A)组和复发肿瘤(B)组,每组再根据治疗方式为新辅助化疗结合手术或单纯新辅助化疗各细分为2组。A组共44例,其中在我院行经动脉新辅助化疗结合手术切除,术后标本或术前穿刺标本病理检查证实为MFH者15例,为A1组;外院首诊并手术切除,病理证实为MFH,术后未行任何治疗就诊于我院,行单纯经动脉化疗后影像学检查发现肿瘤组织消失而未行进一步手术治疗者29例,为A2组。B组共57例,其中外院明确诊断并行肿瘤切除术后复发收入我院,再次行新辅助动脉化疗结合手术切除者45例,为B1组;外院明确诊断并行肿瘤切除术后复发转入我院,行动脉介入化疗后,影像学检查肿瘤组织消失,未行进一步手术者12例,为B2组(图1)。
2.新辅助化疗:所有病例入院后首先进行化疗泵埋置。方法下[11]:局麻下将导管近端插至肿瘤营养动脉的近端,上肢经肱动脉逆行插到锁骨下动脉;下肢经股动脉逆行插到髂外动脉或从健侧股动脉逆行向上,导管通过导丝骑跨导入患侧髂总动脉,再根据需要送至患侧髂外或股动脉水平,然后在皮下置入埋植式动脉化疗泵装置。化疗方案以阿霉素和顺铂为主,联合去甲斑蝥素治疗,手术组术前治疗3个周期,术后3~5个周期;非手术组常规化疗6~8个周期。经化疗泵每天1次动脉给予顺铂40mg/m2,阿霉素30mg/m2,连续给药3天,此为1个周期。术中即常规给于阿霉素30mg。所有患者化疗药物续灌完毕后用5%葡萄糖500ml+去甲斑蝥素40mg/24h,均经化疗泵维持72h。动脉化疗的同时予以水化、利尿、止吐、护肝等辅助治疗。
3.手术:手术组患者根据肿瘤大小、部位、肿瘤与周围解剖结构关系选择手术方式,尽可能采用广泛切除的方式[4]。如果肿瘤组织紧邻大血管神经结构,尽量保留神经血管,对确实无法保留者进行重建。部分病例行局部或游离皮瓣覆盖创面。
三、术后随访及观察指标
对所有病例进行电话随访或来院复查面访。
对于手术患者,切除的肿瘤标本用肿瘤坏死率来判断化疗的疗效:肿瘤坏死率>90%为化疗反应好,肿瘤坏死率<90%为化疗反应差。
观察5年总体生存率、5年无瘤生存率、复发及转移情况。
对患者年龄、性别、肿瘤大小、肿瘤部位、肿瘤浸润组织深度、肿瘤是否复发、病理类型、组织学分级、化疗后组织反应等9项可能影响预后的因素进行分析。
四、统计学分析
应用统计学软件SPSS16.0进行统计分析。计数资料采用卡方检验。采用 Kaplan- Meier法对可能影响预后的因素进行单因素分析, Logrank检验进行统计学比较。采用逐步回归法进行多因素分析。P<0.05为差异有统计学意义。
结果
本组101例随访3~145个月,平均60个月。
一、肿瘤化疗疗效
本研究中共对2组23例肿瘤切除标本进行了肿瘤坏死率分析,A1组5例肿瘤切除标本中肿瘤坏死率75.0%,4例(80.0%)化疗反应好,B1组18例肿瘤坏死率73.8%,14例(77.8%)化疗反应好,两组肿瘤坏死率及化疗反应好者比率相比,差异无统计学意义(P>0.05)。
二、5年生存率
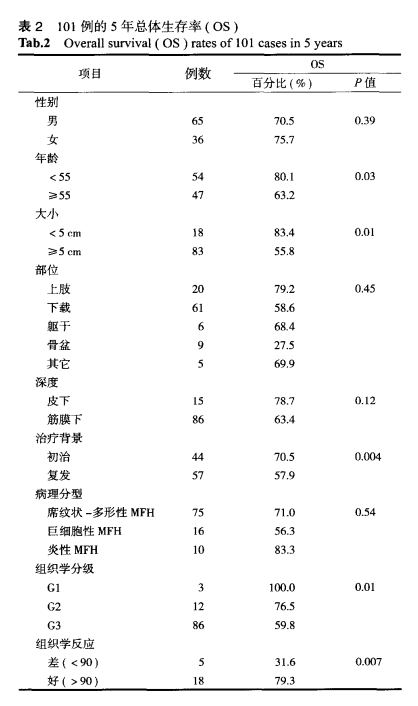
本组总体生存率65.3%,原发组5年无瘤生存率和总体生存率分别为70.5%和75.0%,复发组5年无瘤生存率和总体生存率分别为56.1%和57.9%,且两组的总体生存率相比,差异有统计学意义(P<0.05)。A、B两组无瘤生存率相比,差异无统计学意义(P>0.05)(表1)。

肿瘤直径<5cm者其5年总体生存率83.4%,≥5cm者5年总体生存率55.8%,且5年总体生存率前者大于后者,二者差异有统计学意义(P<0.05)。位于骨盆的胂瘤5年总体生存率最低,只有27.5%。化疗组织反应良好者其5年总体生存率79.3%,化疗组织反应差者5年总体生存率只有31.6%,且5年总体生存率前者大于后者,二者差异有统计学意义(P<0.05)(表2)
三、复发及转移情况
单独局部复发者共18例(17.8%),其中A组7例(15.9%),B组11例(19.3%),平均复发时间14个月,14例(78%)在2年内复发。单独远处转移共5例(5.0%),A组1例(2.3%),B组4例(7.0%),平均转移发生时间1年(2~50个月)。局部复发伴远处转移者共15例(14.9%),其中7例局部复发与远处转移同时发生,8例远处转移发生于局部复发后,转移发生于复发后平均15(2~60)个月,A组5例(11.4%),B组10例(17.5%)。转移部位肺17例(85.0%),骨转移2例(10%)肝转移1例(50%)(表3)。

四、预后分析
5年总体生存率与预后有关因素为:患者年龄(P=0.03)、肿瘤大小(P=0.01)、骨盆部位(P=0.02),肿瘤是否复发(P=0.004)、组织学分级(P=0.01)、化疗后组织反应(P=0.007),而性别、肿瘤部位、肿瘤浸润组织深度、病理类型等因素与预后无关。多因素分析显示,肿瘤大小(P=0.002)、骨盆部位肿瘤(P=0.01)、肿瘤是否复发(P=0.0004)、组织学分级(P=0.002)、化疗后组织反应(P=0.008)是影响预后的最主要因素。
五、化疗后患者一般情况及化疗并发症
本组病例化疗后一般情况均可,主要并发症为中性粒细胞减少症(79%)。其它毒性反应包括:胃肠道反应、肝功能损害、红斑现象、一过性臂丛神经损害等。2例出现继发于阿霉素心肌毒性反应经对症处理后好转。
讨论
软组织MFH侵袭性强,恶性度高,易于复发和转移,预后较差。 Leonhardt等[4]认为单独手术切除在确保广泛边缘切除的前提下可以不辅助放化疗。然而多数学者主张手术结合辅助放化疗,尤其当肿瘤巨大或接近重要组织结构周围很难达到广泛边缘切除时更为必要。
目前,在常见影响MFH的预后因素中,性别对于预后影响很小,而对于年龄与预后的关系争议较大[5-7,12 ]。本研究结果发现性别不是影响预后的因,素。化疗后组织反应、组织学分级、肿瘤大小被多数研究证实是影响预后重要因素,但也有少数研究持否定态度,肿瘤部位、肿瘤浸润组织深度等对预后的影响争议较多[2,4-7,11-12]。本研究显示化疗后组织反应,骨盆部位肿瘤,肿瘤大小,组织学分级是影
响预后的最主要因素,而肿瘤浸润深度不是影响预后的主要因素。
目前公认足够的外科边界切除是影响预后最重要的因素,故本研究未对手术切除边界因素对预后的影响进行重复研究,在临床中按照这一原则尽量采取广泛切除或间室切除的方法。而B组病例由于均为复发病例,瘢痕形成多,肿瘤散在等原因很难获得充分外科边界,分析这可能也是B组病例总体生存率低于A组的原因之一。
影响预后的另一最重要因素是辅助性治疗(放疗或化疗)的影响。化疗对MFH的作用存在定争议: Gutierrez [13]等认为,化疗可能是增加术后死亡率的危险因素;李广学等[6]研究表明化疗组和非化疗组5年总体生存率差异无统计学意义,化疗对于局部复发和远处转移的控制也没有意义。但是这些研究中化疗应用方式多为术后的辅助性化疗而非新辅助化疗,目前越来越多的外科医生开始对高度恶性的软组织肉瘤应用新辅助化疗并取得优良效果[14-16]。Baci等[8]固对一组MFH患者进行3种不同方案的新辅助化疗,平均随访6.5年,70%患者无瘤生存明显高于同期20例单独手术治疗的病例,无瘤生存明显高于同期20例单独手术治疗的病例,无瘤生存率也明显高于作者早期研究中单独应用术后化疗的患者(59%)。本组在肿瘤切除的手术中观察到术前化疗能使肿瘤周围炎性反应区和肿瘤新生血管消失,瘤体缩小,肿瘤周围连续性假膜形成良好,从而为肿瘤的广泛切除提供了良好的切除边界。
肿瘤组织对化疗的反应取决于化疗方案及给药方式,阿霉素与顺铂的联用治疗MFH的可行性被很多研究证实[17-18]。(1)在具体给药方式方面,动脉内给药比静脉内给药具有更大优势[19-20 ]。 Ronald等[11]采用动脉内化疗和静脉化疗结合的方式治疗MFH,10年 Kaplan- Meier生存率达82%,77%患者对化疗效果明显,局部复发率只有4%。尽管目前尚无阿霉素与顺铂均采用动脉给药的方式治疗MFH的报道,然而阿霉素经动脉内给药治疗其它肿瘤已取得很多经验[19-20 ]。因此,在临床工作中将阿霉素、顺铂均于动脉内给药,取得了良好疗效。有研究表明,去甲斑蝥素对多种肿瘤细胞的生长均有抑制作用[21-22 ]。为了增强化疗疗效,在化疗泵内联合应用了去甲斑蝥素。本研究中共有60例化疗后接受手术,手术切除的病理显示肿瘤细胞坏死明显,对肿瘤坏死率进行分析的23例标本中化疗反应良好者>70%,明显优于其它报道[18]。本研究临床效果也证实上述3种药物联合动脉给药的方式具有较强抗肿瘤作用。(2)复发性MFH因扩大切除术后,会出现边界不清、瘢痕挛缩、与神经和血管粘连紧密,再次手术切除风险及复发可能性都很大。采用本方案化疗后,术中见肿瘤血供减少、边界清楚,可以行边缘切除的缩小手术。另外41例经化疗后影像学提示肿瘤组织消失,免除再次扩大切除手术,因未行手术无法取得化疗后组织标本。然而临床上可以看到病变部位疼痛明显减轻或消失、局部皮温降低、肿块变小变硬边界变清晰、皮下组织与肿块间活动度增大;影像学检查可以看到软组织肿块缩小、边界由模糊变清晰、肿瘤内出现钙化等。这说明采用本方案的新辅助化疗能增加化疗疗效、有效控制肿瘤的浸润范围、缩小肿瘤边界、降低再次手术的局部复发率、提高生存率,是一种有效的治疗方法。
化疗泵埋植经动脉输注剂量顺铂和阿霉素的新辅助化疗方案治疗MFH,其优势在于:(1)动脉输注药物后,经动脉灌注区域的引流静脉可获得2~5倍高的血药浓度,且外周血管可获得相同的血药浓度,未损害其系统暴露量[23-24 ];(2)采用动脉给药,避免了静脉给药时药物经肝脏的降解去活性化作用,大剂量化疗可形成局部超高浓度,可通过物理扩散作用直接进入肿瘤细胞内达到有效浓度,并以分子原形对肿瘤细胞发挥作用;(3)局部动脉化疗毒副作用低于同等剂量全身给药,可缩短疗程间隔时间、延长治疗周期、增加化疗药物的剂量强度;(4)标准的动脉新辅助化疗可有效控制和缩小原发肿瘤、显著提高保肢率、降低局部复发率[25];(5)皮下埋植式化疗泵动脉化疗操作简单,患者痛苦小,并可长期、多疗程、持续给药,有利于保持肿瘤供血区域有效药物高浓度时限;(6)持续缓慢经动脉输注阿霉素避免了药物对血管的刺激作用。新辅助化疗提出后,动脉化疗是提高生存率的又一突破性进展,而且采用剂量敏感性的、具有个体化评估的动脉化疗方案可以获得更佳的生存率。
参考文献
[1] O'Brien JE, Stout AP Malignant fibrous xanthomas. Cancer,1964,17:144-1455.
[2] Peiper M, Zurakowski D, Knoefel WT, et al. Malignant fibrous histiocytoma of the extremities and trunk: an institutional review. Surgery, 2004, 135(1): 59-66.
[3] Rosen G, Caparros B, Huvos AG, et al. Preoperative chemothe-rapy for osteogenic sarcoma: selection of postoperative adjuvant chemotherapy based on the response of the primary tumor to preoperative chemotherapy. Cancer, 1982, 49(6): 1221-1230.
[4] Lehnhardt M, Daigeler A, Homann HH, et al. MFH revisited:outcome after surgical treatment of undifferentiated pleomorphic or not otherwise specified(NOS)sarcomas of extremities-an analysis of 140 patients. Langenbeck Arch Surg,2009,394(2):313-320.
[5]Belal A, Kandil A, Allam A, et al. Malignant fibrous histiocytoma: A retrospective study of 109 cases. Am J Clini Oncol,2002,25(1):16-22.
[6]李广学,郭卫,软组织恶性纤维组织细胞瘤的治疗策略和预后分析中华外科杂志,2011,49(11):974977.
[7] Gibbs JF, Huang PP, Lee RJ, et al. Malignant fibrous histiocytoma: an institutional review. Cancer Invest, 2001,191):23-27
[8] Bacci G, Ferrari S, Picci P, et al. Neoadjuvant chemotherapy in malignant fibrous histiocytoma of the limbs: 10 years of experience(1983-1992)at the Rizzoli Orthopedic Institute Minerva Med,1996,87(4):135-146.
[9] Fletcher CDM, Unni KK, Mertens F, et al. Pathology and genetics of tumours of soft tissues and bone. lyon, france LARC Press: 2002, World Health Organization Classification of Tumors.
[10] Enzinger FM, Weiss SW. Soft tissue tumors. ed 4. Louis:
Mosby, 2001.
[11] Hugate RR, Wilkins RM, Kelly CM, et al. Intraarterial hemotherapy for Extremity Osteosarcoma and MFH in Adults. Clin Orthop Relat Res, 2008, 466(6): 1292-1301.
[12] Atalar H, Basarir K, Yildiz Y, et al. Prognostic factors in patients with malignant fibrous histiocytoma of the extremities Acta Orthop Traumatol Ture, 2007, 41(4): 271-276.
[13] Gutierrez JC, Perez EA, Franceschi D, et al. Outcomes for soft tissue sarcoma in 8249 cases from a large state cancer registry J Sung Res,2007,141(1)105-114.
[14] Ham SI, Hoekstra HJ, Van der Graaf WT, et al. The value of high-dose methotrexate-based neoadjuvant chemotherapy inmalignant fibrous histiocytoma of bone. J Clin Oncol, 1996 ,14(2)490-496.
[15] Bacci G, Springfield D, Capanna R, et al. Adjuvant chemoth-erapy for malignant fibrous histiocytoma in the femur and tibia.J Bone Joint Surg [Am], 1985, 67(4): 620-625.
[16] Picci P, Bacci G, Ferrari S, et al. Neoadjuvant chemotherapy in malignant fibrous histiocytoma of bone and in osteosarcoma located in the extremities: analogies and differences betweenthe two tumors. Ann Oncol, 1997, 8(11): 1107-1115.
[17] Nooij MA, Whelan J, Bramwell VH, et al. European Osteosarcoma Intergroup. Doxorubicin and cisplatin chemotherapy in high-grade spindle cell sarcomas of the bone,other than osteosarcoma or malignant fibrous histiocytoma: a European Osteosarcoma Intergroup Study. Eur J Cancer, 2005
41(2):225-230.
[18] Bramwell VH, Steward WP, Nooij M, et al. Neoadjuvant chemotherapy with doxorubicin and cisplatin in malignant fibrous histiocytoma of bone: A European Osteosarcoma Intergroup study. J Clin Oncol, 1999, 17(10): 3260-3269.
[19] Shiba M, Takatera H, Fujii T, et al. Intraarterial chemotherapy with bladder preservation in patients with invasive bladder carcinoma. Hinyokika Kiyo, 2004, 50(1): 15-19.
[20 ]Yayoi E, Furukawa J, Takatsuka Y, et aL. Intra-arterial infusion
chemotherapy in the treatment of advanced breast cancer.doxorubicin versus epirubicin. Gan To Kagaku Ryoho, 1992,19(10Supp):S1621-1624.
[21] Yang PY, Chen MF, Kao YH, et al. Norcantharidin induces apoptosis of breast cancer cells: involvement of activities of mitogen activated protein kinases and signal transducers and activators of transcription. Toxicol In Vitro, 2011, 25(3)699-707.
[22] Kanoh S, Umeyama T, Nemoto S, et al. Long-term intra-arterial infusion chemotherapy with adriamycin for advanced bladder cancer. Cancer Chemother Pharmacol, 1983,(11 Suppl):s51-58.
[23] Stewart DJ, Benjamin RS, Zimmerman S, et al. Clinical pharmacology of intraarterial cis-diammine-dichloroplatinum(I). Cancer Res,1983,43(2)917-920.
[24] Jaffe N, Knapp J, Chuang VP, et al. Osteosarcoma: intra arterial treatment of the primary tumor with cisdiammine-dichloroplatinum II(CDP). Angiographic, pathologic, and pharmacologic studies. Cancer, 1983, 51(3): 402-407.
[25] Wilkins RM, Cullen JW, Camozzi AB, et al. Improved survival in primary nonmetastatic pediatric osteosarcoma of the extremity. Clin Orthop Relat Res, 2005, 438: 128-136.(收稿日期:2015-01-04)
点击快速进入预约挂号系统
Nelo351
我今年6月份乳腺癌复发,我的一个癌症朋友介绍我来广州中医药大学金沙洲医院做全身热疗,他也是前段时间在这边做热疗跟粒子植入。我做了5个疗程的热疗后,复查发现病情得到了控制,在做热疗的时候人也没其他不适。

健康平安251
我妈妈一段时间身体各种不舒服,到医院检查发现是肺癌,打听到邓医生治癌症很厉害,15年6月份就到金沙洲医院住院,做了热疗和化疗,幸好也没有出现别人说的化疗副作用,觉得很奇怪的问了邓医生,说是因为用了小剂量的化疗,这才没有出现化疗的副作用。

淡然153
天有不测风云,我在12年单位体检胆管癌,在当地医院手术后无接受其他治疗,但在两年后复查后发现转移,马上转至广州中医药大学金沙洲医院接受更好的治疗,做了4次全身热疗和小剂量的化疗,现在只要定期复查就好了。
发布成功!评论待院方审核后才能生效!

(本网站已加密,绝对保障个人隐私)